lunes, 10 de septiembre de 2018
semana#30
Cuarto periodo
Proyectos de emprendimiento
- Proyecto newton - Quien quiere ser millonario}
- Bio qca- m.o - Aperitivos
Proyectos escogido
Productos lácteos
Títulos
Objetivos
Materiales
Marco teórico
Presentación del producto
Muestra
Productos que se haran
Yogurt
Kumis
Cuajada
Araquipe
Panelitas de coco
Integrantes
Manuela Murillo
Susna Gracia Loaiza
Any Guzman
Sonia Contreras
William Perez Marrugo
Proyectos de emprendimiento
- Proyecto newton - Quien quiere ser millonario}
- Bio qca- m.o - Aperitivos
Proyectos escogido
Productos lácteos
Títulos
Objetivos
Materiales
Marco teórico
Presentación del producto
Muestra
Productos que se haran
Yogurt
Kumis
Cuajada
Araquipe
Panelitas de coco
Integrantes
Manuela Murillo
Susna Gracia Loaiza
Any Guzman
Sonia Contreras
William Perez Marrugo
domingo, 2 de septiembre de 2018
semana#28
Mecanismo de las reacciones orgánicas
Ruptura y/o formación de enlaces
Toda reacción química implica una ruptura de los enlaces existentes en las moléculas que reaccionan y la formación de otros nuevos en los productos resultantes. El estudio de los mecanismos de las reacciones, nos lleva a considerar la serie de pasos concretos que se producen en la transformación de las sustancias reaccionantes en productos de reacción.
Teniendo en cuenta el mecanismo de ruptura o formacion de enlaces, las reacciones se clasifican:
a) Reacciones de homólisis / homogénicas
b) Reacciones de heterólisis / heterogénicas
c) Reacciones pericíclicas
semana#27
REACCIONES ORGANICAS
*Los enlaces son fuertes, normalmente las energías de activación son elevadas y las velocidades de reacción lentas
* Para acelerarlas es habitual o bien el uso de catalizadores, o la elevación de la temperatura
i) Según la forma de ruptura o formación de enlaces:
*Reacciones homolíticas (homo-lisis = igual-ruptura): Estas reacciones involucran radicales.
*Reacciones heterolíticas (hetero-lisis = diferente-ruptura): Estas reacciones involucran iones: carboaniones y carbocationes
ii) Según la relación existente entre los reactivos y los productos de la
reacción:
* Reacciones de adición:
Son aquellas en las cuales todos los átomos de los reactivos van a formar parte
de un único producto. Uno de los reactivos (al que podemos llamar sustrato)
debe contener un enlace doble, o uno triple:
*Reacciones de eliminación:
Son conceptualmente opuestas a las de adición. En este tipo de reacciones, a
partir de un compuesto y generalmente por acción de un segundo reactivo, se
produce la pérdida de los átomos equivalentes a una molécula pequeña, y la
formación de un nuevo producto, insaturado (con enlace doble o triple):
*Reacciones de sustitución:
Son las que involucran dos reactivos de los cuales uno es el sustrato, y el otro
es una molécula o ión generalmente pequeño (el que sustituye); los cuales
forman otra molécula y otra entidad pequeña (molécula o ión) (la cual es
desplazada).
semana#26
LABORATORIO:

REACCIONES ORGÁNICAS
Proposito:
-Reconocer experimentalmente aldehídos y cetonas, acidos carboxílicos y obtener acetileno.
-Reconocer las propiedades fisicas de algunos compuestos.
Proposito:
-Reconocer experimentalmente aldehídos y cetonas, acidos carboxílicos y obtener acetileno.
-Reconocer las propiedades fisicas de algunos compuestos.

semana#25
Isomería Óptica
semana#24
Enantiomeros y diastereómeros
El diastereomerismo se produce cuando dos o más estereoisómeros de un compuesto tienen configuraciones diferentes en una o más, pero no todas las equivalentes relacionadas. Los estereocentros no son imágenes especulares uno del otro. Cuando dos diastereoisómeros se diferencian entre sí en un solo estereocentro, son epímeros. Cada estereocentro da lugar a dos configuraciones diferentes y por lo tanto aumenta el número de estereoisómeros en un factor de dos.
Los diastereoisómeros se diferencian de los enantiómeros ya que estos últimos son los pares de estereoisómeros que difieren de todos los estereocentros y por lo tanto son reflejos uno del otro. Los enantiómeros de un compuesto con más de un estereocentro también son llamados diastereoisómeros de los otros estereoisómeros del compuesto que no es su imagen especular. Los diastereómeros tienen diferentes propiedades físicas y diferente reactividad, a diferencia de los enantiómeros.
semana#23
Isomeria conformacional
los enlaces simples entre átomos tienen simetría cilíndrica y permiten la rotación de los grupos que unen. Las diferentes disposiciones espaciales que adoptan los átomos como consecuencia de la rotación en torno al enlace se llaman conformaciones. Una conformación concreta de las múltiples posibles se denomina confórmero.
La rotación del enlace carbono-carbono en el etano da lugar a dos conformaciones límite -la conformaciones alternada (con los hidrógenos alternados) y la conformación eclipsada (con los hidrógenos enfrentados-. El paso de la conformación alternada a la eclipsada o viceversa se realiza por giro de 60º. Obsérvese que en un giro de 360º existen infinitas conformaciones posibles.
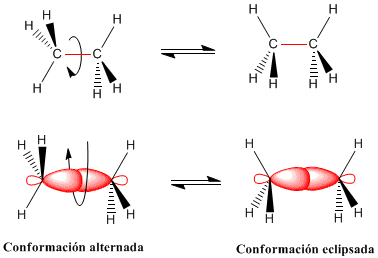
semana#22
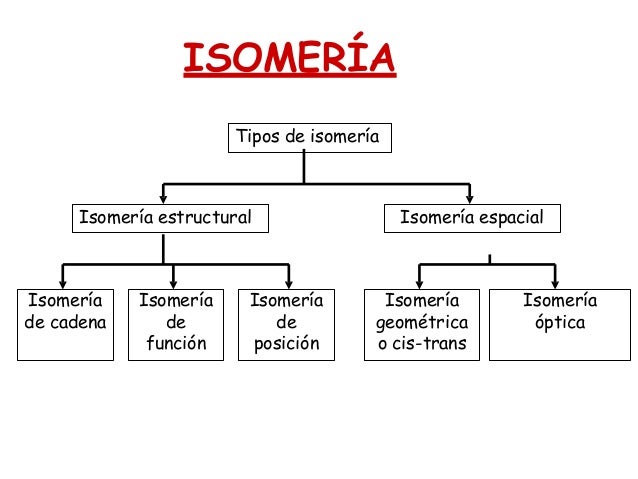
Isomeria estructural
existen 3 tipos:
*ISOMEROS DE CADENA:
Los isómeros de este tipo tienen componentes de la cadena acomodados en diferentes lugares, es decir las cadenas carbonadas son diferentes, presentan distinto esqueleto o estructura.
Un ejemplo es el pentano, del cual existen varios isómeros, pero los más conocidos son el isopentano y el neopentano.
Es la de aquellos compuestos en los que sus grupos funcionales están unidos en diferentes posiciones.
Un ejemplo simple de este tipo de isomería es la del pentanol, donde existen tres isómeros de posición: 1-pentanol, 2-pentanol y 3-pentanol.
*ISOMERIA DE FUNCIÓN:
Aquí, la diferente conectividad de los átomos, puede generar diferentes grupos funcionales en la cadena. Un ejemplo es el ciclohexano y el 1-hexeno, que tienen la misma fórmula molecular (C6H12), pero el ciclohexano es un alcano cíclico o cicloalcano y el 1-hexeno es un alqueno.
ISOMERIA ESPACIAL
Se clasifican en 2:
*GEOMETRICA CIS-TRANS:
La isometría cis-trans es un tipo de estereoisomería, la cual se refiere a los compuestos que tienen sus átomos conectados en el mismo orden pero tienen diferente orientación tridimensional. Este tipo de isomería presenta en cicloalcanos (serie de carbonos que conforman un anillo) y en alquenos (cadena de carbonos unidos por una doble ligadura). Se produce cuando existen dos grupos idénticos para comparar y se encuentran en diferentes posiciones.
* ISOMERIA OPTICA:
Cuando un compuesto tiene al menos un átomo de Carbono asimétrico o quiral, es decir, un átomo de carbono con cuatro sustituyentes diferentes, pueden formarse dos variedades distintas llamadas estereoisómeros ópticos, enantiómeros, formas enantiomórficas o formas quirales, aunque todos los átomos están en la misma posición y enlazados de igual manera. Esto se conoce como regla de Le Bel-van't Hoff

semana#21
Isomeria
La isomería es una propiedad de ciertos compuestos químicos que con igual fórmula química, es decir, iguales proporciones relativas de los átomos que conforman su molécula, presentan estructuras moleculares distintas y, por ello, diferentes propiedades. Dichos compuestos reciben la denominación de isómeros. Los isómeros son compuestos que tienen la misma fórmula molecular pero diferente fórmula estructural y, por tanto, diferentes propiedades. Por ejemplo, el alcohol etílico o etanol y el éter dimetílico son isómeros cuya fórmula molecular es C2H6O.

jueves, 12 de julio de 2018
domingo, 27 de mayo de 2018
semana#17
preparación de exposición aldehidos y cetonas
GRADO: 11-1
PREGUNTA PROBLEMATIZADORA:
¿De qué manera puede obtenerse un aldehído a partir de un alqueno?
R: Un alqueno, cuando se hidroliza forma un alcohol, el cual puede ser oxidado para formar un aldehído

CETONA QUE ES ?:
Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo unido a dos átomos de carbono. Las cetonas suelen ser menos reactivas que los aldehídos dado que los grupos alquílicos actúan como dadores de electrones por efecto inductivo.Las cetonas se forman cuando dos enlaces libres que le quedan al carbono del grupo carbonilo se unen a cadenas hidrocarbonadas.
ESTRUCTURA:
Las cetonas son compuestos parecidos a los aldehídos, poseen el grupo carbonilo (C=O) , con la diferencia que estas en vez de hidrogeno, contiene dos grupos orgánicos. Es decir, que luce una estructura de la forma RR’CO, donde se puede presentar que los grupos R y R’ sean alfáticos o aromáticos.

PROPIEDADES QUÍMICAS
Reacciones de adición:
Reacciones de hidratación de cetonas:Al añadir una molécula de agua H-OH al doble enlace carbono-oxígeno, resulta un diol. Si se produce un diol con los dos grupos –OH unidos al mismo tiempo, se le llama hidrato. En la reacción de formación de estos, el grupo –OH del agua se une al átomo de carbono del carbonilo, mientras que el –H al átomo de oxígeno carboxilo

Adición de alcoholes:
Al adicionar alcoholes (ROH) a las cetonas se producen hemicetales. Como ejemplo de esta formación esta la reacción entre la acetona y el alcohol etílico. No obstante, los hemicetales no son estables, tienen un bajo rendimiento y en su mayoría no pueden aislarse de la solución.

Adición de amoníaco y sus derivados:
Las cetonas reaccionan con el amoníaco NH3, o con las aminas para formar un grupo de sustancias llamadas iminas o bases de Schiff. Las iminas resultantes son inestables y continúan reaccionando para formar, eventualmente, estructuras más complejas.
Reacción general

Adición del reactivo de Grignard:
Reactivo de Grignard son compuestos organometálicos utilizados en numerosas reacciones orgánicas de síntesis. Al reaccionar dicho reactivo con una cetona se forman alcoholes terciarios con cadenas carbonadas más largas que los compuestos carbonilos que los originaron. Al ser el reactivo de Grignard polarizado debido a la diferencia en las electronegatividades del carbono y del magnesio, ataca primero al oxígeno del carbonilo para después atacar al carbono carbonilo. Como resultado de esta reacción, se obtiene un alcohol terciario.

Reacción de sustitución:
Halogenación:
Se da la halogenación cuando una cetona está en presencia de una base fuerte. La reacción de sustitución ocurre en el carbono contiguo al grupo funcional. No obstante, puede reaccionar más de un halógeno, sustituyendo los hidrógenos pertenecientes a la cadena.

OBTENCIÓN:
las cetonas se pueden obtener a partir de reacciones químicas y las que se encuentran en la naturaleza. Respecto a las reacciones, los métodos más importantes son mediante la oxidación de alcoholes secundarios, ozonólisis de alquenos, hidratación de alquinos, y a partir de reactivos de Grignard.
Oxidación de alcoholes secundarios:
Siendo el método más utilizado, los oxidantes que se usan son dicromato de potasio K2Cr2O7, trióxido de cromo CrO3, y permanganato de potasio KMnO4 diluidos en piridina o acetona. Las cetonas, al ser obtenidas mediante esta oxidación, son resistentes a una posterior, por lo que se pueden aislar del oxidante con facilidad.

Hidratación de alquinos:
Se le adiciona agua a los alquinos en los carbonos que contienen el triple enlace, mediante catalizadores como mercurio Hg y ácido sulfúrico H2SO4. De esta manera se obtiene como resultado una cetona.

Los alquinos se pueden hidratar Markovnikov, formando cetonas

Si son alquinos terminales da lugar a la obtención de metilcetonas. Si el alquino es interno se puede obtener una mezcla de cetonas
 Fuentes naturales
Fuentes naturales
En la naturaleza se pueden encontrar cetonas ampliamente distribuidas en diferentes campos, están en la fructosa, en las hormonas cortisona, testosterona y progesterona, así como también en el alcanfor, que es utilizado como medicamento tópico. También, el mismo cuerpo humano las secrete cuando no hay suficientes hidratos de carbono. Este es el estado de cetosis que se explicará mas adelante.
QUE ES?:
Los aldehídos son compuestos que resultan de la oxidación suave y la deshidratación de los alcoholes primarios.

El grupo funcional de los aldehídos es el carbonilo al igual que la cetona con la diferencia que en los aldehídos van en un carbono primario, es decir, de los extremo
Nomenclatura:
Al nombrar a los aldehídos solamente tenemos que cambiar la terminación de los alcoholes “ol” por la terminación “al”. Como el ejemplo expuesto arriba, Etanol pasa a Etanal. También existen aldehídos con dobles enlaces sobre la cadena hidrocarbonada.En estos casos se respeta la nomenclatura de los alquenos que utilizan las terminaciones “eno”. Por ejemplo:

Aldehídos aromáticos:
En estos casos el grupo funcional aldehído esta unido al anillo o núcleo aromático.

La preparación de aldehídos alifáticos se basa en la oxidación de los alcoholes
 Obtención por hidratación del acetileno:
Obtención por hidratación del acetileno:
El etenol se descompone con facilidad y forma el aldehído.

Obtención por reducción de ácidos orgánicos:

Obtención por reducción de cloruros de ácido: Se reduce el cloruro de etanoílo en presencia de hidrógeno y un catalizador de paladio. R representa la longitud de la cadena carbonada. Por ej si R tiene una longitud de 2 carbonos en total habrán 3 y será el propanal.

Propiedades Químicas:
Los aldehídos tienen buena reactividad. Presentan reacciones de adición, sustitución y condensación.
Adición de Hidrógeno:El hidrógeno se adiciona y se forma un alcohol primario.

Reducción del Nitrato de plata (AgNO3) amoniacal (Reactivo de Tollens). La plata en medio amoniacal es reducida por el aldehído. Esto se verifica por la aparición de un precipitado de plata llamado espejo de plata en el fondo del tubo d ensayo. En primer lugar se forma hidróxido de plata.
AgNO3 + NH4OH → NH4NO3 + AgOH
semana#15
realización del taller del documento como practica para el taller en esta semana se vio la explicaion teorica de como resolver el taller
grupos funcionales

grupos funcionales

semana#14
se trabajo en la sala de informatica y se recibio clase teorica sobre el benceno y nomenclatura de ciclos se repartieron los temas del proyecto de cada grupo de trabajo y se trabajo tambien la wiki para dicho proyecto

grupo #3
integrantes:laura villegas
juan pablo zapata
luisa fernanda alegria
manuela murillo



grupo #3
integrantes:laura villegas
juan pablo zapata
luisa fernanda alegria
manuela murillo

semana#13
continuación de documento de nomenclatura
NOMBRE DE LA RAIZ
El nombre de la raíz se designa mediante un término que indica su número de átomos de carbono, aunque algunas veces y por eufonía se le adiciona la letra (a) ej. Hept --- Hepta.
RAICES INDICATIVAS DEL NÚMERO DE CARBONOS
PREFIJOS
Son todas las designaciones que aparecen antes de la raíz
PREFIJO PRIMARIO
Es un término antepuesto a la raíz y relacionado con su naturaleza; se emplean las palabras como ciclo (cadena cerrada) espirano, biciclo, etc. Pero si la cadena es abierta no se utiliza ningún término.
PREFIJOS SECUNDARIOS
Son las funciones secundarias y las ramificaciones carbonadas.
FUNCIONES SECUNDARIAS
Es el conjunto restante de grupos funcionales de un compuesto, después de seleccionar la función principal, los cuales se designan mediante los términos descritos anteriormente.
Las funciones secundarias se nombran, conjuntamente con los radicales, en orden alfabético, especificando la posición que ocupa en la cadena principal, el número de veces que se repiten (multiplicidad: di, tri, tetra, etc.) y su nombre particular; al escribir lo anterior, las posiciones se especifican con los números (y algunas veces letras usadas como localizadores n, N etc.) separados por comas entre sí y por un guión de la letra siguiente; por ej. 2,3 – dihidroxi; N, N dimetil amina etc.
RADICALES O RAMIFICACIONES Un radical o ramificación es cada conjunto carbonado que no es grupo funcional, situado por fuera de la secuencia principal y como ya se anotó, se lee conjuntamente con las funciones secundarias en orden alfabético, especificando su posición (es) multiplicidad y nombre, pero es necesario anotar que para radicales sencillos el orden alfabético no es afectado por la multiplicidad
NOMBRE DE LA RAIZ
El nombre de la raíz se designa mediante un término que indica su número de átomos de carbono, aunque algunas veces y por eufonía se le adiciona la letra (a) ej. Hept --- Hepta.
RAICES INDICATIVAS DEL NÚMERO DE CARBONOS
|
# C
|
RAIZ
|
# C
|
RAIZ
|
# C
|
RAIZ
|
# C
|
RAIZ
|
# C
|
RAIZ
|
|
1
2
3
4
5
|
met
et
prop
but
pent
|
6
7
8
9
10
|
hex
hept
oct
non
dec
|
11
12
13
14
15
|
Undec
Dodec
Tridec
Tretadec
pentadec
|
20
21
30
31
40
|
Eicos
Uneicos
Triacont
Unetriacont
tetracont
|
50
60
70
80
100
200
|
Penta cont
Hexa cont
Hepta cont
Octa cont
Hect
dihect
|
PREFIJOS
Son todas las designaciones que aparecen antes de la raíz
PREFIJO PRIMARIO
Es un término antepuesto a la raíz y relacionado con su naturaleza; se emplean las palabras como ciclo (cadena cerrada) espirano, biciclo, etc. Pero si la cadena es abierta no se utiliza ningún término.
Son las funciones secundarias y las ramificaciones carbonadas.
FUNCIONES SECUNDARIAS
Es el conjunto restante de grupos funcionales de un compuesto, después de seleccionar la función principal, los cuales se designan mediante los términos descritos anteriormente.
Las funciones secundarias se nombran, conjuntamente con los radicales, en orden alfabético, especificando la posición que ocupa en la cadena principal, el número de veces que se repiten (multiplicidad: di, tri, tetra, etc.) y su nombre particular; al escribir lo anterior, las posiciones se especifican con los números (y algunas veces letras usadas como localizadores n, N etc.) separados por comas entre sí y por un guión de la letra siguiente; por ej. 2,3 – dihidroxi; N, N dimetil amina etc.
RADICALES O RAMIFICACIONES Un radical o ramificación es cada conjunto carbonado que no es grupo funcional, situado por fuera de la secuencia principal y como ya se anotó, se lee conjuntamente con las funciones secundarias en orden alfabético, especificando su posición (es) multiplicidad y nombre, pero es necesario anotar que para radicales sencillos el orden alfabético no es afectado por la multiplicidad
sábado, 12 de mayo de 2018
semana#12
nomenclatura de hidrocarburos ramificados con instauraciones
trabajamos el documento llevado por el profesor Ali ENLACE
tema: nomenclatura
objetivo:aplicar las normas segun IUPAC para nombrar compuestos organicos
INTRODUCCIÓN
La comunicación sobre cualquier tema depende de un idioma; para la Química se ha desarrollado un lenguaje especial (nomenclatura) que es necesario conocer par facilitar la comunicación entre las personas relacionadas con esta área del saber.
La nomenclatura debe ser funcional y precisa, de tal manera que cada compuesto orgánico sea identificable mediante un solo nombre, el cual a la vez se relaciona con su estructura. Aunque existen mas compuestos orgánicos (de los que nos interesa estudiar) algunos poseen mas de un nombre aceptado y utilizado, pues existe una tendencia generalizada entre los químicos: dar a los compuestos nombres comunes, no relacionados con sus estructuras específicas, sino con su origen, fuente de obtención, método de preparación, sitio de su descubrimiento etc. ; por ej. El ácido fórmico, ácido acético, acetaldehído, ácido oleico, etc. ; sin embargo, cuando el químico necesita reportar algo acerca de un compuesto orgánico debe utilizar en sus publicaciones su nombre sistemático para facilitar la identificación de la estructura por parte del lector; es por ello que se hace énfasis en los nombres sistemáticos, que se ajustan a las reglas de nomenclatura aceptadas internacionalmente, las cuales han evolucionado por cerca de cien años, son el resultado del estudio cuidadoso y el acuerdo previo entre los miembros de una organización de químicos denominada I.U.P.A.C (unión internacional de Química pura y aplicada).
Resumiendo, todo el nombre sistemático está estructurado así:
PREFIJO 2º PREFIJO 1º RAIZ SUFIJO 1º SUFIJO 2º
SUFIJO SECUNDARIO
Los grupos funcionales contenidos en la tabla 1. Están ordenados, según lo establecido convencionalmente por la I.U.P.A.C, en orden decreciente de importancia; por ejemplo, si un compuesto en su estructura tiene los grupos funcionales –COOH, C=O y OH, la función principal es –COOH y las demás son secundarias y por lo tanto, el nombre del compuesto termina en OICO.
CADENA PRINCIPAL O RAIZ
Es la secuencia carbonada progenitora del compuesto particular y equivale al hidrocarburo no ramificado del mismo número de átomos de carbono; dicha secuencia es común para todos los compuestos que resulten de sustituir uno ó más hidrógenos de ese hidrocarburo por átomos diferentes al carbono y que originan grupos funcionales.
miércoles, 14 de marzo de 2018
semana#8
hidrocarburos ramificados
Como el átomo de carbono requiere de cuatro uniones a otros átomos, es posible que algunos compuestos se formen con uniones en las que dos átomos de carbono estan unidos al mismo átomo.
De esta forma nos referimos a átomos de carbono primarios(1°), secundarios (2 °), terciarios(3°) or cuaternarios (4 °) de acuerdo a el número de átomos de carbono unidos directamente a el, más aún esta designación se puede extender a átomos que no son de carbono o grupos unidos a carbono.Así un carbono 3 ° tiene otros tres carbonos unidos a el, y, para un alcano, un hidrógeno que por extensión se denomina hidrógeno 3 °
Como el átomo de carbono requiere de cuatro uniones a otros átomos, es posible que algunos compuestos se formen con uniones en las que dos átomos de carbono estan unidos al mismo átomo.
De esta forma nos referimos a átomos de carbono primarios(1°), secundarios (2 °), terciarios(3°) or cuaternarios (4 °) de acuerdo a el número de átomos de carbono unidos directamente a el, más aún esta designación se puede extender a átomos que no son de carbono o grupos unidos a carbono.Así un carbono 3 ° tiene otros tres carbonos unidos a el, y, para un alcano, un hidrógeno que por extensión se denomina hidrógeno 3 °

semana#7
radicales
El nombre sistemático de los hidrocarburos de cadena lineal consta de tres partes:
la primera alude al número de carbonos de la molécula. El número de carbonos viene indicado por distintos prefijos (Figura de la derecha)
la segunda parte indica el tipo de enlaces presentes en la cadena carbonada: Si todos son sencillos se indica por -an-; un doble enlace se indica por -en- y un triple enlace se indica por -in-. Si hay más de un doble o triple enlace, se colocan los prefijos di, tri, tetra, etc.
la tercera parte del nombre hace referencia al carácter hidrocarburo del compuesto, y se indica por la terminación -o.
Al sustituir un hidrógeno de un hidrocarburo por una valencia libre se obtiene un radical. Los radicales se nombran como el hidrocarburo de origen, sustituyendo la terminación -o por la terminación -il o -ilo. Si el hidrocarburo es saturado se omite la partícula -an- (Figura de la izquierda).

El nombre sistemático de los hidrocarburos de cadena lineal consta de tres partes:
la primera alude al número de carbonos de la molécula. El número de carbonos viene indicado por distintos prefijos (Figura de la derecha)
la segunda parte indica el tipo de enlaces presentes en la cadena carbonada: Si todos son sencillos se indica por -an-; un doble enlace se indica por -en- y un triple enlace se indica por -in-. Si hay más de un doble o triple enlace, se colocan los prefijos di, tri, tetra, etc.
la tercera parte del nombre hace referencia al carácter hidrocarburo del compuesto, y se indica por la terminación -o.
semana#6
hidrocarburos
alcanos:Los alcanos son compuestos formados exclusivamente por carbono e hidrógeno (hidrocarburos), que solo contienen enlaces simples carbono-carbono.
Tipos de alcanos
Los alcanos se clasifican en lineales, ramificados, cíclicos y policíclicos.
Nomenclatura de alcanos
Los alcanos se nombran terminando en -ano el prefijo que indica el número de carbonos de la molécula (metano, etano, propano...)
Propiedades físicas de los alcanos
Los puntos de fusión y ebullición de alcanos son bajos y aumentan a medida que crece el número de carbonos debido a interacciones entre moléculas por fuerzas de London. Los alcanos lineales tienen puntos de ebullición más elevados que sus isómeros ramificados.
Tipos de alcanos
Los alcanos se clasifican en lineales, ramificados, cíclicos y policíclicos.
Nomenclatura de alcanos
Los alcanos se nombran terminando en -ano el prefijo que indica el número de carbonos de la molécula (metano, etano, propano...)
Propiedades físicas de los alcanos
Los puntos de fusión y ebullición de alcanos son bajos y aumentan a medida que crece el número de carbonos debido a interacciones entre moléculas por fuerzas de London. Los alcanos lineales tienen puntos de ebullición más elevados que sus isómeros ramificados.
alquenos:Los alquenos son hidrocarburos insaturados que tienen uno o varios enlaces carbono-carbono en su molécula. Se puede decir que un alqueno es un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre de cicloalquenos.
Antiguamente se les denominaba como olefinas dadas las propiedades que presentaban sus representantes más simples, principalmente el eteno, para reaccionar con halógenos y producir óleos.
Antiguamente se les denominaba como olefinas dadas las propiedades que presentaban sus representantes más simples, principalmente el eteno, para reaccionar con halógenos y producir óleos.

alquinos:Los alquinos son hidrocarburos que contienen enlaces triples carbono-carbono. La fórmula molecular general para alquinos acíclicos es CnH2n-2 y su grado de insaturación es dos. El acetileno o etino es el alquino más simple, fue descubierto por Berthelot en 1862.
Los alquinos responden a la fórmula CnH2n-2 y se nombran sustituyendo el sufijo -ano del alca-no con igual número de carbonos por -ino.
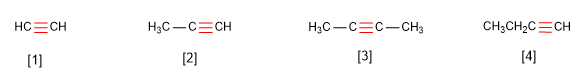
semana#5
ciclo del carbono

Estando Wohler en su laboratorio en Berlin, había obtenido cianato de amonio y lo estaba hirviendo para cristalizarlo. Se formaron entonces, unos grandes cristales incoloros que bien sabía Friedrich que no eran del compuesto que él pensaba cristalizar. Al analizarlos llegó a la conclusión de que eran de Urea. Había sintetizado un compuesto orgánico "urea" a partir de compuestos inorgánicos "cianato de amonio"....El vitalismo no tenía sentido.
Wohler escribió a su maestro Berzelius: "Debo decir que puedo hacer urea sin intervención de un riñón animal, sea de hombre o de perro".
Este hecho pone fin a la Teoria Vitalista de Berzelius.

teoría vitalista
Wohler escribió a su maestro Berzelius: "Debo decir que puedo hacer urea sin intervención de un riñón animal, sea de hombre o de perro".
Este hecho pone fin a la Teoria Vitalista de Berzelius.
semana#4
ley de Graham
La ley de Graham, formulada en 1829 por el químico británico Thomas Graham, establece que las velocidades de difusión y efusión de los gases son inversamente proporcionales a las raíces cuadradas de sus respectivas masas molares.

Siendo {\displaystyle v} las velocidades y {\displaystyle M}
las velocidades y {\displaystyle M} las masas molares.
las masas molares.
Efusión es el flujo de partículas de gas a través de orificios estrechos o poros.
Se hace uso de este principio en el método de efusión de separación de isótopos.
El fenómeno de efusión está relacionado con la energía cinética de las moléculas. Gracias a su movimiento constante, las partículas de una sustancia se distribuyen uniformemente en el espacio libre. Si hay una concentración mayor de partículas en un punto habrá más choques entre sí, por lo que hará que se muevan hacia las regiones de menor número: las sustancias se efunden de una región de mayor concentración a una región de menor concentración.
La ley de Graham, formulada en 1829 por el químico británico Thomas Graham, establece que las velocidades de difusión y efusión de los gases son inversamente proporcionales a las raíces cuadradas de sus respectivas masas molares.

Siendo {\displaystyle v}
 las velocidades y {\displaystyle M}
las velocidades y {\displaystyle M} las masas molares.
las masas molares.Efusión es el flujo de partículas de gas a través de orificios estrechos o poros.
Se hace uso de este principio en el método de efusión de separación de isótopos.
El fenómeno de efusión está relacionado con la energía cinética de las moléculas. Gracias a su movimiento constante, las partículas de una sustancia se distribuyen uniformemente en el espacio libre. Si hay una concentración mayor de partículas en un punto habrá más choques entre sí, por lo que hará que se muevan hacia las regiones de menor número: las sustancias se efunden de una región de mayor concentración a una región de menor concentración.
Suscribirse a:
Entradas (Atom)











