LEY DE LOS GASES
Según la Ley de los volúmenes de combinación esta misma relación es la que ocurre entre los volúmenes de los gases en una reacción química. Por ello, debe de existir una relación directa entre estos volúmenes de gases y el número de moléculas que contienen.
La ley de Avogadro dice que:
Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas.

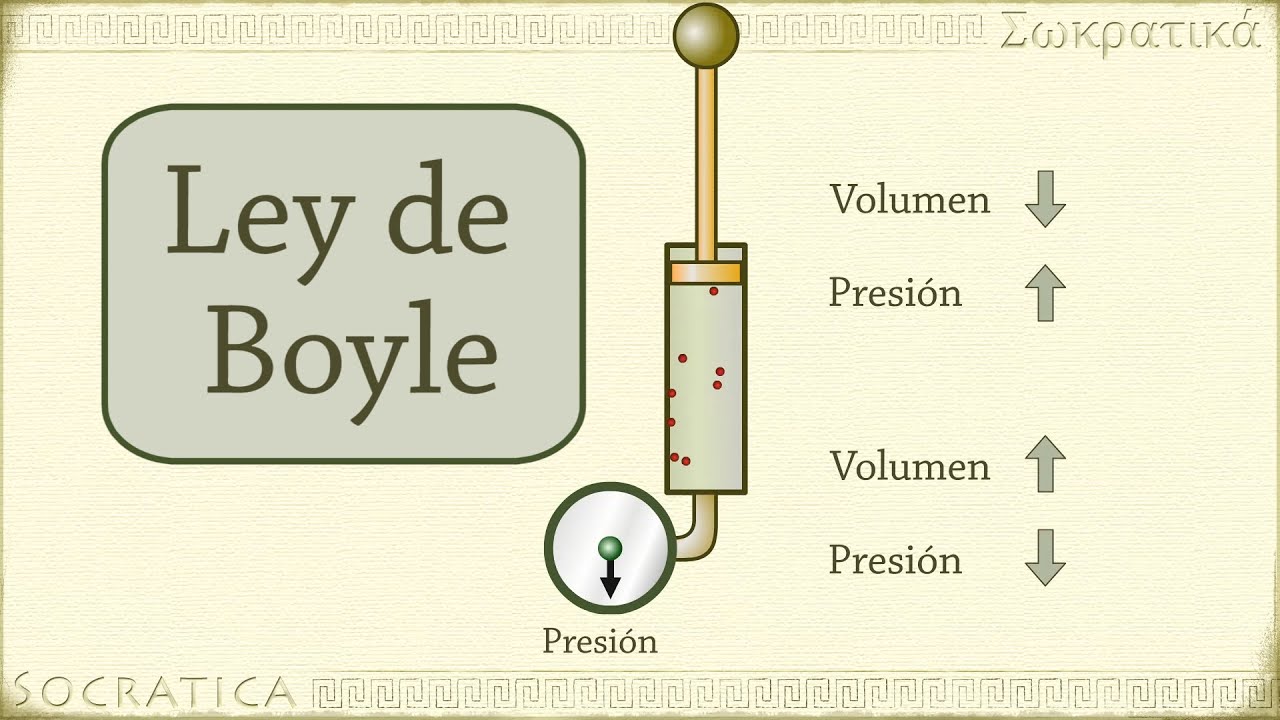
LEY DE BOYLE: Esta ley nos permite relacionar la presión y el volumen de un gas cuando la temperatura es constante.
La ley de Boyle (conocida también como de Boyle y Mariotte) establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando latemperatura es constante .
Lo cual significa que:
El volumen de un gas es inversamente proporcional a la presión que se le aplica:
- Si la presión aumenta, el volumen disminuye.
- Si la presión disminuye, el volumen aumenta.
LEY DE CHARLES: La Ley de Charles es una ley de los gases que relaciona el volumen y la temperatura de una cierta cantidad de gas a presión constante.
En 1787 Charles descubrió que el volumen del gas a presión constante es directamente proporcional a su temperatura absoluta (en grados Kelvin): V = k · T (k es una constante).
Por lo tanto:
En 1787 Charles descubrió que el volumen del gas a presión constante es directamente proporcional a su temperatura absoluta (en grados Kelvin): V = k · T (k es una constante).
Por lo tanto:
V1 / T1 = V2 / T2
- Si la temperatura aumenta el volumen aumenta
- Si la temperatura disminuye el volumen disminuye

LEY DE GAY-LUSSAC:Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
La presión del gas es directamente proporcional a su temperatura:
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor: (el cociente entre la presión y la temperatura es constante)
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:

La presión del gas es directamente proporcional a su temperatura:
- Si aumentamos la temperatura, aumentará la presión.
- Si disminuimos la temperatura, disminuirá la presión.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor: (el cociente entre la presión y la temperatura es constante)
PT=kPT=k
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
P1T1=P2T2
